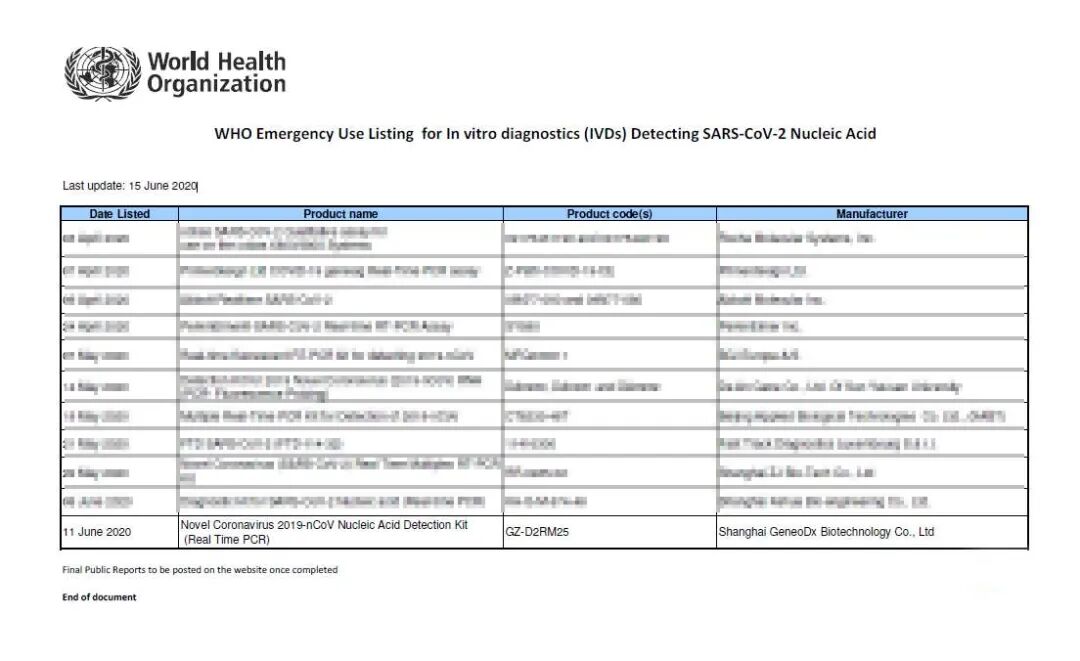
6月11日,国药中国生物上海捷诺生物科技有限公司(以下简称:中生捷诺)的新型冠状病毒核酸检测试剂盒列入世界卫生组织(World Health Organization,缩写WHO)应急使用清单(Emergency Use Listing,简称EUL)。
EUL是WHO资格预审应对紧急公共卫生状况的一种机制。通过WHO应急审批的产品,将被列入到WHO的产品清单,为世界卫生组织、联合国机构及其他国家或地区的诊断产品采购提供依据。
新冠疫情爆发后,WHO资格预审小组宣布,WHO产品紧急使用清单(EUL)将向检测SARS-CoV-2(最初称为2019-nCoV)的体外诊断产品厂商开放。
▲中生捷诺新冠病毒核酸检测试剂盒列入WHO应急使用清单
针对此次新冠疫情,中生捷诺快速响应,迅速投入研究开发,经过设计、优化和试验,首家成功研制出新冠病毒核酸检测试剂盒,并于第一时间送至中国疾控中心验证,首批列入国家卫健委工作指南,成为被推荐的三家供应企业之一,首批取得了国家药品监督管理局颁发的新冠病毒核酸检测试剂盒医疗器械注册证,同时积极参与WHO的EUL申请。截至6月15日,全球共有11家企业的新型冠状病毒检测产品列入WHO的应急使用清单,中生捷诺作为中国企业位列其中。

此前,中生捷诺已完成了该核酸检测试剂盒的欧盟CE认证。4月初,中生捷诺所属荷兰分子诊断子公司PathoFinder的SARS-CoV-2检测试剂,RealAccurate Corona-plus PCR Kit 获得欧盟CE认证,该试剂可同时检测新型冠状病毒SARS-CoV-2和中东呼吸道综合征病毒MERS。
------------------------------------------------------------------------------ End
1500人QQ大群,欢迎加入 1号QQ群:140978441 2号QQ群:951835987
IVD原料世界--微信公众号
|  |1号QQ群:140978441|2号QQ群:951835987|Archiver|手机版|IVD原料论坛-抗体世界旗下的论坛
|1号QQ群:140978441|2号QQ群:951835987|Archiver|手机版|IVD原料论坛-抗体世界旗下的论坛